Seit Februar 2019 stellt die EU-Fälschungsschutzrichtlinie sicher, dass Arzneimittelpackungen durch verpflichtende Serialisierung entlang der gesamten Lieferkette geschützt sind. Jede einzelne Verpackung erhält im 2D-DataMatrix-Code eine eindeutige Seriennummer und einen integrierten Manipulationsschutz. Die Authentizität wird über das zentrale European Medicines Verification System sowie in Deutschland über securPharm in Echtzeit überprüft. b+b Automations- und Steuerungstechnik betont Qualitätssicherung und unterstreicht korrekte Datenverarbeitung. Zusätzlich steht eine detaillierte, praxisorientierte, umfassende Checkliste zur effizienten Prozessoptimierung bereit.
Inhaltsverzeichnis: Das erwartet Sie in diesem Artikel
EU-FMD verpflichtet seit 2019 zur Serialisierung für mehr Patientensicherheit

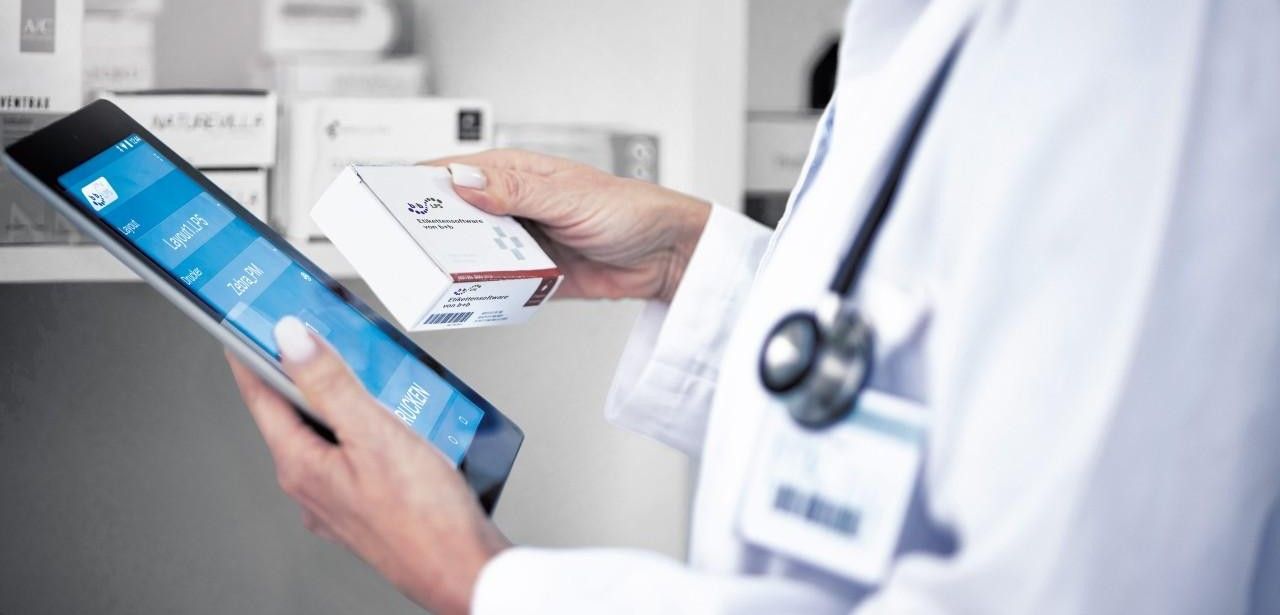
bb TE PV Pharmaserialisierung (Foto: b+b Automations- und Steuerungstechnik GmbH)
Illegale Nachahmungen von Arzneimitteln führen nicht nur zu direkten gesundheitlichen Risiken für Patienten, sondern schwächen zugleich das Vertrauen in staatliche Gesundheitsstrukturen nachhaltig. Um dem entgegenzuwirken und die Integrität der zugelassenen Lieferkette zu gewährleisten, hat die Europäische Union bereits im Jahr 2011 mit der Falsified Medicines Directive (FMD) einen umfassenden regulatorischen Rahmen etabliert, der darauf abzielt, durch verpflichtende Maßnahmen zur Serialisierung und Echtheitsverifikation gefälschter Verpackungen ab Februar 2019 verbindliche Standards umzusetzen.
Serialisierung schützt Arzneimittel effektiv mit individueller Seriennummer und DataMatrix-Code
Die Serialisierung bildet das zentrale Element des FMD-Sicherheitskonzepts: Jede einzelne Arzneimittelpackung erhält während der Produktion eine eindeutige Seriennummer, die im 2D-DataMatrix-Code maschinenlesbar hinterlegt wird. Zusätzlich integriert ein Erstöffnungsschutz mechanische Sicherungselemente am Verschluss, die jede gewünschte Manipulation sichtbar machen. Dadurch lässt sich bereits beim ersten Entpacken feststellen, ob das Produkt unverändert ist. Dieses Verfahren stärkt die lückenlose Rückverfolgbarkeit und schützt Patienten vor Fälschungen effektiv. Es gewährleistet Integrität und Compliance entlang der Lieferkette.
DataMatrix-Code speichert automatisiert GTIN, Seriennummer, Chargen- und Verfallsdaten zuverlässig
Der integrierte DataMatrix-Code enthält verpflichtend den eindeutigen Produktcode (GTIN, NTIN oder PPN), die individuelle Seriennummer, die Chargenkennung sowie das Verfallsdatum. Diese vier Datenelemente bilden eine einmalige Kombination, die eine präzise Identifikation jeder einzelnen Packung ermöglicht. Durch maschinenlesbare Kennzeichnung und zentrale Speicherung lässt sich der Warenfluss lückenlos überwachen, Rückverfolgbarkeit sicherstellen und Manipulationen oder Fälschungsversuche entlang der gesamten Lieferkette effektiv verhindern.
Datenqualität wird oft unterschätzt und verursacht Warnungen im Verifikationssystem
Die b+b Automations- und Steuerungstechnik GmbH weist darauf hin, dass mangelhafte Datenqualität in Serialisierungsprozessen häufig unterschätzt wird. Unvollständige oder fehlerhafte Datensätze führen zu Redundanzen bei Warnmeldungen im zentralen Verifikationssystem, wodurch Abläufe in Produktion und Logistik signifikant beeinträchtigt werden. Um Verzögerungen und Unterbrechungen zu vermeiden, sind präzise Datenvalidierungsstrategien und eine kontinuierliche Überwachung der Dateneingabeparameter unabdingbar, um Prozessstabilität und Effizienz sicherzustellen. Regelmäßige Audits und definierte Qualitätskennzahlen verbessern die Datenintegrität und damit wesentlich.
EMVS verbindet Hersteller, Apotheken und Kliniken für sichere Echtzeit-Arzneimittelechtheit
Das European Medicines Verification System (EMVS) fungiert als zentrales Datenbanksystem zur Echtheitsprüfung von Arzneimitteln innerhalb Europas. Pharmahersteller übermitteln ihre Serialisierungsdaten verschlüsselt an den zentralen Hub, wo sie konsolidiert werden. Nationale Prüfplattformen wie securPharm greifen in Echtzeit auf diese Informationen zu und führen bei Abgabe in Apotheken oder Kliniken eine Validierung durch. So lässt sich die Integrität jeder Packung durchgängig, strukturiert, transparent und eindeutig nachvollziehen; potenzielle Betrugsversuche erkennt das System umgehend.
Unklare Ausschleusungsprozesse erschweren stabilen Pharmabetrieb trotz technischer Implementierung weiterhin
Obwohl die technischen Systeme erfolgreich implementiert wurden, offenbaren sich im Betriebsalltag verschiedene Schwachstellen. Unklare Ausschleusungsprozesse führen zu falschen Freigaben oder Blockaden einzelner Datensätze. Die Umsetzung des Decommissionings ist häufig inkonsistent, sodass verifizierte Objekte im System verbleiben. Fehlende Abstimmung zwischen Druck, Verifizierung und Datenmanagement verursacht zusätzliche Verzögerungen. Zudem bleibt die Aggregationsdatennutzung unvollständig, wodurch Transparenzverluste und ineffiziente Abläufe die tägliche Produktions- und Logistiksteuerung erheblich beeinträchtigen. Dies erhöht Aufwand und Kosten spürbar deutlich.
b+b Checkliste deckt Druck, Verifizierung, Datenmanagement und EMVS-Anbindung ab
b+b hat eine praxisorientierte Checkliste erstellt, die alle relevanten Risikobereiche in Produktions- und Logistikprozessen erfasst. Sie behandelt sämtliche Druckprozesse einschließlich Qualifizierung und Kalibrierung von Geräten, Verifizierungsabläufe nach EMVS-Standards, Datenmanagement mit Validierungsanforderungen und Schnittstellenanbindung zum European Medicines Verification System. Zusätzlich werden Sonderprozesse wie internationale Exporte, Retourenmanagement und Lohnverpackung berücksichtigt, um Compliance sicherzustellen und Abläufe zu dokumentieren. Die Checkliste dient als Leitfaden für Hersteller, Verpacker und Logistikdienstleister und fördert eine standardisierte Prozessqualität.
Automatisierte Chargen- und Verfallsdatenerfassung ermöglicht präzise Analysen und Optimierungen
Durch die lückenlose Serialisierung werden Chargen- und Verfallsdaten automatisiert erfasst, was manuelle Fehler reduziert und Rückrufe zielgerichteter ermöglicht. Zudem steigert die verbesserte Transparenz entlang der Lieferkette die Präzision von Lagerbestandsanalysen und minimiert Engpässe. Die automatisierten Datenerfassungsprozesse erlauben belastbare Durchlaufzeitmessungen für komplexe Produktionslinien. Kombiniert mit optimierten Vertriebsweg-Analysen trägt dieses System nicht nur zum Fälschungsschutz bei, sondern dient als strategisches Tool zur Effizienzsteigerung in der Pharma-Logistik und Qualitätsverbesserung sowie deutlicher Effizienzgewinn.
Track-and-Trace-Systeme dokumentieren künftig vollständig alle Stationen der Pharma-Lieferkette digital
Experten prognostizieren eine umfassende Digitalisierung aller Stationen der pharmazeutischen Lieferkette mittels Track-and-Trace-Systemen. Diese ermöglichen eine lückenlose Dokumentation und Rückverfolgbarkeit jedes einzelnen Produktions- und Distributionsschritts. In der Folge entwickelt sich die Serialisierung zu einem strategischen Baustein moderner Pharma-Logistik. Sie garantiert erhöhte Sicherheit vor Produktfälschungen, optimiert Warenströme durch Echtzeiteinblicke und steigert insgesamt die operative Effizienz, indem automatisierte Abläufe sowie Echtzeitdaten eine fundierte Steuerung erlauben.
EU-FMD-Serialisierung stärkt Arzneimittelschutz, Compliance und betriebliche sowie nachhaltige Effizienzgewinne
Die Einführung der Serialisierung gemäß EU-FMD verstärkt die Sicherheit im Arzneimittelbereich und sorgt für erhöhte Compliance durch lückenlos erfasste Produktdaten. Präzise Serialnummern, Chargen- und Verfallsinformation ermöglichen eine Echtzeit-Verifikation und optimieren Rückrufprozesse. Strukturierte Checklisten tragen zur Risikominimierung bei, während die Transparenz der Lieferkette verbessert wird. Hersteller und Lohnverpacker profitieren nicht nur von regulatorischer Verlässlichkeit, sondern erschließen zudem langfristige Effizienzpotenziale in der modernen Pharma-Logistik unter strikter Einhaltung gesetzlicher Vorgaben und effektive Kontrollmechanismen.